-
實驗室儀器
按功能分按專業實驗室分
- 化學合成
- 乳品類檢測專用儀器
- 細胞工程類
- 種子檢測專用儀器
- 病理設備
- 1. 乳品類檢測專用儀器
- 1. 種子檢測專用儀器
- 層析設備
- 動物實驗設備
- 糧油檢測
- 生物類基礎儀器
- 植物土壤檢測
- 1. 電泳(電源)儀、電泳槽
- 2. 分子雜交
- 3. 基因工程
- 4. PCR儀
- 5. 紫外儀、凝膠成像系統
- 藥物檢測分析
- 地質
- 紡織
- 分析儀器
- 農產品質量監測
- 1. 農藥殘毒快速檢測儀
- 2. 農產品檢測試紙
- 3. 農產品檢測試藥片
- 4. 土壤、化肥快速檢測儀
- 5. 種子外觀品質分析儀
- 水產品質量安全
- 水產技術推廣
- 水生動物防疫
- 食品檢測實驗室
- 疾病預防控制中心
- 1. 快速檢測試劑盒
- 2. 肉類檢測儀器
- 3. 食品安全快速分析儀
- 4. 食品安全檢測箱
- 5. 食品檢測儀器配套設備
- 6. 食品安全檢測儀器
- 7. 三十合一食品安全檢測儀
- 8. 相關配置、配件
- 供水、水文監測
-
暫無數據,詳情請致電:18819137158 謝謝!
-
暫無數據,詳情請致電:18819137158 謝謝!
-
暫無數據,詳情請致電:18819137158 謝謝!
-
暫無數據,詳情請致電:18819137158 謝謝!
-
暫無數據,詳情請致電:18819137158 謝謝!
-
暫無數據,詳情請致電:18819137158 謝謝!
熱銷品牌 - 工業儀器
- 戶外儀器
- 環境監測
- 便攜式儀器
- 在線式儀器
2015年CFDA監管模式或變革
[2014/12/5]
在2014年11月結束的第26屆全國醫藥經濟信息發布會上,法制司的吳莉雅做了題為《藥品管理法修訂情況介紹》的報告,介紹了《藥品管理法》修訂情況的最新進展和整體思路。其中提到,為了應對日益復雜的藥品監管趨勢,新《藥品管理法》擬建立如下監管思路:
逐步下放和取消藥品GMP和GSP認證制度,將認證制度和藥品企業準入標準,以及日常生產、經營行為的監管結合起來,減少審批監管,加強日常監督檢查力度。飛行檢查,就是這些措施中的有力之一。
在《藥品管理法》中明確增加召回制度的規定,以解決下位法和上位法的矛盾沖突問題。
第一、建立雙罰制度,對企業法人和質量受權人(自然人)進行連帶處罰措施,并建立黑名單和禁入制度。
第二、增加約談和警告信制度。
在目前過渡階段,為了確保藥品質量穩定和安全可靠,CFDA近期多次派出飛行檢查組,對相關企業進行飛行檢查。同時,國家局也督促各相關省局,加派人力,對自己轄區內的企業,進行大力度的抽查和跟蹤檢查。
例如,2014年10月23日,國家食品藥品監督管理總局(CFDA)發布飛行檢查情況通知,分別對長春遠大國奧制藥公司、陜西摩美得制藥有限公司和浙江錢江(譙城)中藥飲片有限公司進行調查和處罰。從CFDA通知披露的信息看,這幾家企業所犯問題不是一般的技術違規,而是涉及違法問題,性質很嚴重。
進入11月份開始,CFDA的飛行檢查力度和密度更大,監管趨勢更嚴厲。筆者根據CFDA網站和各省局網站公布的相關信息,匯總2014年度的飛行檢查情況如下:
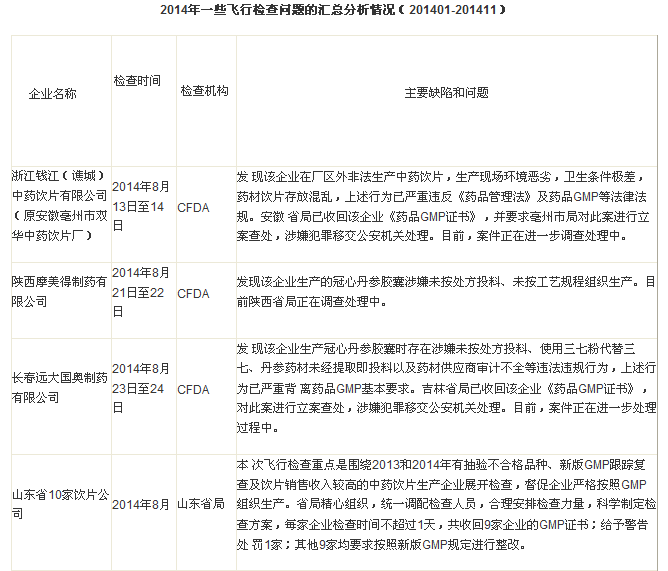
另外據可靠消息,國內已經有至少7家企業按照現場核查結合GMP認證組合檢查的模式,接受了國家局核查和檢查。這個新的模式,類似于國外的檢查模式,即不再一個企業多次檢查,而是在產品注冊階段,進行一次檢查。而企業接受核查和GMP認證檢查后,一旦獲得批準文號,就不需要再接受GMP認證檢查,而是直接獲得GMP證書。
從以上這些監管方式轉變看,CFDA力圖結合《藥品管理法》的修訂,對既往的監管模式進行變更,以高強度、有實效的日常監管模式代替以往的重審批,輕監管的管理模式。















 河南、湖北、湖南、廣東、廣西、海南: 楊經理 19811942171 微信同號
河南、湖北、湖南、廣東、廣西、海南: 楊經理 19811942171 微信同號
 地址:廣州市越秀區先烈中路76號15樓B、C
地址:廣州市越秀區先烈中路76號15樓B、C 電話:020-37636032、020-37618752、020-37611206
電話:020-37636032、020-37618752、020-37611206 手機:18819137158
手機:18819137158  傳真:020-37618517
傳真:020-37618517 廣州研發中心:廣州市蘿崗區科學城瑞發路1號
廣州研發中心:廣州市蘿崗區科學城瑞發路1號


